《细胞工程实验》课程实验教学大纲
一、课程概况(CourseOverview)
课程名称:细胞工程实验A
Course:Biochemistry Experiment A
课程编号: 0081800039 适用学生:生物技术
Course Number:0081800039 Designed for:
学分:1 学时:36 独立设课:是
Credit:1 Class hour:36 Independent course:yes
预修课程:植物学、动物学、细胞生物学、生物化学、分子生物学
Preparatory courses:
二、课程简介(Course Descriptions)
细胞工程实验是一门以动植物细胞的离体操作为基础的实验课程,是近年来生物技术专业开设的一门新兴课程。本课程的实验内容包括无菌操作技术,植物细胞培养,动物细胞培养,细胞杂交等基本技能训练,学会相关仪器的使用。通过本实验课程的学习,在巩固和加深细胞工程理论知识的基础上,使学生掌握细胞工程基本技术,能进行独立的实验操作,训练应用细胞工程相关技术从事研发工作的基本思路。
三、实验项目一览表(Experiment project schedule)
序号 No. | 实验名称 Name | 每组人数 Members of each group | 实验 时数 Hours | 实验类型 设计∕验证∕综合 Course Type Verifying/Synthetic/Designing | 必做∕选做 Required Course /Elective Course |
1 | 植物细胞悬浮培养 Plant Cell Suspension Culture | 2 | 3 | 验证 | 必做 |
2 | 植物细胞固定化培养 Plant Cell Immobilization Culture | 2 | 6 | 验证 | 必做 |
3 | 植物原生质体的分离和培养 Isolation and Culture of Plant Protoplast | 2 | 9 | 验证 | 必做 |
4 | 骨髓瘤细胞的培养和制备 Culture of myeloma | 3 | 3 | 验证 | 必做 |
5 | 免疫脾细胞的制备 | 3 | 3 | 验证 | 必做 |
6 | Hybridization of myeloma and spleen cells | 5 | 3 | 验证 | 必做 |
7 | 动物细胞的原代培养 Primary culture of animal cells | 3 | 3 | 验证 | 必做 |
8 | 细胞冻存和复苏 Freezing storage and recovery of cells | 3 | 3 | 验证 | 必做 |
9 | 细胞活性测定 Determination of cell activity | 3 | 3 | 验证 | 必做 |
四、推荐教材及参考书目 (Recommended Teaching Materials and Reference Books)
1.推荐教材
Recommended Teaching Materials:
《细胞工程实验》李志勇高等教育出版社ISBN:9787040309928 出版日期:2010 年12月
2.参考书目
Reference Books
《细胞生物学实验》辛华 主编 科学出版社
五、考核与评价方式(Course Evaluation)
课堂表现和实验报告
六、场地、设备与器材(Site, equipment and consumable materials)
场地
10幢-404-406,407-409生物技术专业实验室-细胞工程实验分室
设备与器材
细胞培养室,超净工作台,二氧化碳培养箱,酶标仪,烘箱,电泳仪,电泳槽,分光光度计,冰箱,低温贮存箱,液氮罐,电子天平,台式离心机,水浴锅,倒置显微镜,灭菌锅,微波炉,光照培养箱,试剂瓶,滴管,试管,试管架,试管夹,酒精灯,移液器,不锈钢桶式过滤器,柜式空调机,低速离心机,冷藏冷柜,连续移液器,真空干燥箱,显微镜操作系统,玻棒,镊子,培养皿,锥形瓶,烧杯,磁力搅拌器,量筒,注射器,塑料桶,离心管,枪头,枪头盒,方盘等。
撰写人:齐庆远徐根娣审定人:郭卫东
《细胞工程实验》课程实验项目1
植物细胞悬浮培养
一、实验目的
1.了解分离与细胞悬浮培养的全过程
2.学习在无菌条件下进行整个植物细胞悬浮培养全程序的实验方法和操作技术
二、实验内容
用事先经一段时间培养好的植物愈伤组织进行悬浮培养
三、实验原理
将植物细胞或较小的细胞团浮在液体培养基中进行培养,并在振荡条件下培养一段时间后,可形成分散悬浮培养物,这种培养物在培养过程中能够保持良好的分散状态。可以成为一种细胞悬浮培养系统,这种悬浮系为细胞的生理、生化、遗传和分化的机理提供实验材料,此技术也为利用植物细胞进行次生代谢物的工业生产提供技术基础。植物细胞悬浮培养比之愈伤组织培养有显著的优点:其一,悬浮培养细胞增殖速度快,能适合于大规模如同微生物发酵方式的工业化生产;其二,悬浮液培养生产的细胞分化程度低且较均一,不像愈伤组织块细胞间已具明显的分化;其三,尽管由于植物细胞具有互相集聚的特殊性,但只要适当控制条件仍能获得大量游离的单细胞,用于多种目的的研究和应用。
四、实验方法与步骤
(一)植物细胞悬浮培养
1.液体培养基的配制,培养基配方根据不同植物细胞培养所需的要求而定,不加琼脂。分装灭菌或已灭菌的培养基进行分装.
2.用镊子夹取生长旺盛的松软愈伤组织,放入三角烧瓶中并轻轻夹碎。每100ml三角烧瓶含灭过菌的培养基10-15ml,每瓶接种愈伤组织的量为1-1.5g,以保证最初培养物中有足够量的细胞。或将愈伤组织块放入含有玻璃珠的培养基内,以利细胞分散。
3.将接种好的三角烧瓶置于摇床上。以80~120次/min的速度振荡培养,室温25~28℃。
(二)继代培养
培养4-5天后,要进行细胞继代培养,若细胞明显增殖,可向培养瓶中加新鲜培养基10ml,必要时,可以分成二瓶,继续培养。(若细胞无明显增殖,可能是起始材料不适当,应考虑用旺盛增殖期的愈伤组织重新接种)。继代5-6次。
五、实验要求
实验内容要求:充分预习,在操超净台上独立完成。实验中操作要仔细,操作结束后及时把超净台面收拾干净,以便下组同学实验。
实验报告要求:
实验报告应包括下列各项:
(1)实验报告的题目、目的、原理(要简明确切);
(2)写报告人及同组人员的姓名;
(3)实验仪器和试剂(包括主要仪器的规格、主要试剂的名称);
(4)实验数据记录(包括原始数据记录表格和整理后的数据记录表格);
(7)实验结果。
(8)分析与讨论,要对实验操作中注意事项,发现的问题应进行讨论,对实验方法、实验设备有何改进建议也可写入此栏;
(9)回答思考题。
考核评价要求:以出勤、随堂提问、预习情况、实验操作情况及实验报告
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:烧杯,镊子,各型号的三角烧瓶,封口膜,棉线,酒精灯,酒精棉花,火柴,标签纸或记号笔,滴管,滤纸,试剂瓶,电炉或微波炉,天平称,称量纸,高压灭菌锅,摇床,超净工作台,培养箱或培养室。愈伤组织,70%乙醇,无菌水,MS培养基(见附录),生长素,细胞分裂素,NaOH,HCl,蔗糖等
《细胞工程实验》课程实验项目2
植物细胞固定化培养
1.学习细胞固定化培养的方法。
2.检测细胞生长状态。
二、实验内容
用平板进行植物细胞固定化培养,培养后测定细胞的生长量
三、实验原理
由单个高等植物细胞在特定条件下通过有丝分裂能形成细胞团,并进而诱导分化出植株。这一方法对选择各种生化突变型和开展多种植物细胞工程研究是重要的基础工作。但由于植物细胞有一定的密度依赖性及其他目前尚不清楚的原因,通常单细胞培养是很困难的,仅在很少几种植物中获得成功。目前使用的方法大致有平板培养、微室培养、看护培养。本实验采用平板培养法。
四、实验方法与步骤
(一)细胞固化培养
1、将处于对数生长期的实验1的细胞悬液或其他植物的细胞悬液,在超净台内经400目尼龙网过滤至离心管内。
2、计数后取总数为2.5×103个细胞的悬浮液移入新的离心管内,1000r/min离心5min,弃去上清液。
3、将沉淀用25mlMS培养液悬浮,再用400目尼龙网过滤。
4、将25ml融化的MS固体培养基冷却至30-35℃左右时,与25ml细胞过滤悬液充分混匀。
5、取混匀液10ml迅速加入培养皿中,待凝固后用溶化的石蜡封好培养皿边缘.(也可用parafilm封),倒置镜下记数,算出密度(细胞数/cm2)。
6、置25℃黑暗培养室培养,21天后在体视镜下计数,算值板率(即形成细胞团的百分率)。
形成的细胞团可以移入分化培养基中诱导成植株,或用于其他目的的研究。
(二)细胞生长的检测
1.细胞团大小,测定细胞培养物的的过滤:经继代培养几次后,培养液中应主要由单细胞和小细胞团(不多于20个细胞)组成。若仍含有较大的细胞团,可用适当孔径的金属网筛过滤,再将过滤后的悬浮细胞继续培养。或者待振荡至细胞分散后,将三角烧瓶重新移入超净工作台内,用400目尼龙网将细胞振荡过滤至烧杯中,取1滴悬液至血细胞计数板上,在倒置显微镜下记数。
1.根据记录结果,将悬液收集离心(1500r/min,5min)后,用MS液体培养基调整细胞悬液体积,使浓度达105个/ml。
2.将悬液20ml倾入三角烧瓶中,在28℃黑暗的培养培养条件下振荡培养(50次/min)。培养期间进行悬浮培养细胞生长的定期检测,生理指标的检测,并绘制细胞生长曲线图。
3.细胞计数。㈠对于分散度较好的悬液:①摇匀细胞悬浮液。②吸一滴细胞乳浊液,滴到计数板上,将盖玻片由一边向另一边轻轻盖下,再用两手的母指紧压盖玻片的两边,使盖玻片和计数板完全密合,以防形成气泡。③2~3分钟以后细胞沉到计数板表面上,然后,将计数板放在显微镜载物台的中央孔上,即可调节显微镜粗细螺旋寻找细胞进行计数,并换算成每毫升的细胞数。㈡对于具有小细胞团较多的悬液:①摇匀细胞悬浮液,取一定体积的细胞悬液于试管中。②向试管中加入2倍体积的8%的三氧化铬(CrO3),将试管置于70℃水浴处理15min。③试管移出水浴冷却后,用吸管重复吹打细胞悬液,使细胞充分分散。④混匀后,细胞计数。方法同㈠的①~③。
4.在不同时期进行细胞计数,可以得到细胞增殖曲线图。
5.细胞鲜/干重的测定。㈠、细胞鲜重的测定。在继代培养的不同时间,取一定体积的悬浮细胞培养液,离心(1500r/min,5min)收集后,(事先称量离心管),去上清液,并将离心管倒置在滤纸上,吸去多余的水份,称量离心管和细胞的重量,得细胞鲜重。或取一定体积的细胞悬液于事先称重的尼龙网上,滤去培养基,吸去多余的培养液,称重。以细胞鲜重为纵坐标,培养时间为横坐标,绘制细胞生长鲜重曲线图。㈡、细胞干重的测定。把上述鲜重细胞进行烘干,再称重。通常在60~70℃烘箱内烘干12小时以上,冷却后称重。同时绘制细胞生长干重曲线图。
6.细胞大小测定。测定细胞的大小一般用物镜测微尺和目镜测微尺配合使用。①先将目镜测微尺装入目镜的光圈板上,然后,将物镜测微尺放在载物台上,使有刻度部分对准载物台的中央孔。②转动转换盘使物镜对准载物台的中央孔,调节粗细升降螺旋使目、物镜测微尺刻度呈现并清晰。③调整目镜及推进尺,使物镜测微尺和目镜测微尺刻度线重合,如物镜测微尺(X)刻度与目镜测微尺(Y)刻度重合,则可求出目镜测微尺(Y)每格代表的实长(10X/Yμm)*。④撤下物镜测微尺,换上装有悬浮培养细胞的装片,调节粗细升降螺旋螺旋使悬浮细胞呈现,用目镜测微尺量度悬浮细胞的直径。最后,将其换算成实际长度(μm),此长度即为该细胞的长度。
*物镜测微尺每格长度:物镜测微尺1mm分成100格,每格实长为1000μm/100格=10μm /格。
也可用计数板进行测定
7.细胞体积的检测。取一定间隔期的细胞悬浮培养液15ml,放入一刻度离心管中,用2000转/分离心速度离心5分钟。然后对着离心管的刻度读出沉降下来的细胞团的体积,求出每毫升培养液中细胞所占的体积数。
细胞活力的检测。在细胞培养的不同阶段,吸取一滴细胞悬液,放在载玻片上,滴一滴0.1%酚藏花红溶液(用培养基配制)染色,在显微镜下观察,凡活细胞均不着色,而死细胞则很快被染成红色。也可用0.1%荧光双醋酸酯溶液染色,凡活细胞将在紫外光诱发下显示蓝绿色荧光。
五、实验要求
同上
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:超净工作台,恒温水浴锅,普通离心机,培养室,倒置显微镜,体视显微镜,离心管,三角烧瓶,烧杯,400目尼龙网,滴管,血球记数板,培养皿,移液管 parafilm,MS培养液所需的各种药品和试剂等。
《细胞工程实验》课程实验项目3
植物原生质体的分离和培养的实验技术
一、实验目的
学习植物细胞原生质体分离和纯化及细胞计数的方法
二、实验内容
从植物叶片分离用原生质体进行培养,同时学习原生质体计数
三、实验原理
植物原生质体是除去细胞壁后为原生质所包围的“**细胞”,是开展基础研究的理想材料。其中酶解法分离原生质体是一个常用的技术,其原理是植物细胞壁主要由纤维素、半纤维素和果胶质组成,因而使用纤维素酶、半纤维素酶和果胶酶能降解细胞壁成分,除去细胞壁,即可得到原生质体。
由于原生质体内部与外界环境之间仅隔一层薄薄的细胞膜,必须保持在渗透压平衡的溶液中才能保持其完整性。其次,还应当考虑取材、酶的种类和纯度、酶液的渗透压、酶解时间及温度等因素对分离原生质体的影响。
四、实验方法与步骤
(一).原生质体的分离
1.叶片清洗:把叶片洗净,把表面水吸干,放在培养皿内萎蔫40分钟(萎缩时间因天气而异,一般30~60分钟)。(3~4人一组,10-406实验室中进行)
2.超净台上常规消毒。
3.叶片消毒:取灭过菌的烧杯,叶片放入其内,取0.1%HgCl2溶液倒入烧杯以浸满叶片为宜,浸泡10 分钟,把0.1%HgCl2溶液倒回原来的试剂瓶中。0.1%HgCl2可重复使用,请勿当废液倒弃。
4.用无菌水(已灭过菌的水)冲洗3~4次。必须把0.1%HgCl2溶液从叶片中彻底清除。
5.把叶片放入已灭过菌的培养皿中,用镊子撕去叶片背面的表皮,用2ml离心管的盖打下1圆片。
6.圆片浸入0.8ml酶中。在2 ml离心管内已含0.8ml-1.5ML酶解液(4%纤维素酶, 2%果胶覆酶,PH5.8,0.6mol/L甘露醇;此酶液已过滤灭菌),每试管放2~3片。每组4管,每人1管。
(注意:撕下表皮的叶片部分,应立即剪下放入酶液,以免叶肉细胞干燥细胞死亡)
7.离心管盖紧,移出超净台,
8.转移至10-402房间光照培养箱中,30℃保温酶解2~4h(酶解时间根据酶解程度的情况而定)。
9.保温酶解期间每隔30min,轻轻摇动试管1次。
(二).原生质体的收集与纯化
1.保温酶解完成后,把酶解试管移回超净工作台。
2.离心管70%酒精棉擦拭消毒后,再打开离心管盖。
3.用移液枪吸出酶解液,滴入已有400目尼龙网的2ml离心管中。每1支酶解液过滤于1离心管中,过滤除去未消化的组织。取出过滤网。
4.500rpm 离心3min,吸除上清液,留沉淀。
5.加1ml培养液,用移液枪轻轻吹动,混匀。用力不可太大,以免原生质体破裂。
6.500rpm 离心3min,吸除上清液,留沉淀。
7.每离心管加0.5ml培养液, 用移液枪轻轻吹动,混匀。合并于1支离心管中。
8.取3滴到另1支离心管(该离心管细胞液已并到另一支离心管中),用于细胞计数。
(三).原生质体的培养与观察
1. 2个同学到10-406室进行细胞计数。算出细胞的浓度(个/ml)。速度要快,而在超净台的同学等着你的结果。细胞培养的最适浓度为50000个/ml左右(每毫升5万个左右)。用血球计数板计数细胞密度。
2.均分装成4支2ml离心管中,然后加入培养液进行调节细胞的浓度。每支离心管的最终溶液:最少为0.3ml, 最多为1ml。根据分离的细胞浓度进行调节。分离的细胞少,培养液少加;分离的细胞多,培养液可多加,可分装成5支离心管中进行培养。
3.心管盖好,用透明胶带密封,放在10-406实验室的光照培养箱中进行培养(暗培养)。细胞分裂成团后才进行光照培养。
4.观察细胞壁再生和细胞分裂。
(四).细胞计数
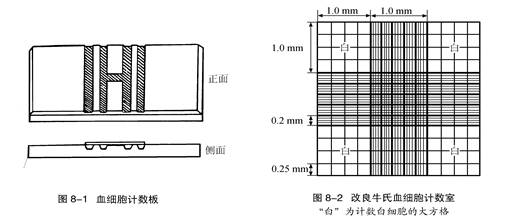
取干洁的计数板,置于水平的显微镜载物台上,盖上盖玻片,使两侧各空出少许。摇匀细胞悬液,用滴管吸取,将滴管尖轻轻置于盖玻片边缘外,让滴出的血细胞悬液凭毛细管作用吸入计数室内,刚好充满计数室为宜(图8-3)。静置2min后计数,先用低倍镜观察,不均匀则抛弃。计数时用虹彩、集光器、反光镜等调节入射光角度和强度,认清计数室位置。采用“由上至下,由左至右,顺序如弓”的顺序,对压边线细胞采取“数上不数下,数左不数右”的原则(图8~4)。依次计数并记录4个大方格中分别有多少个细胞。
在下图(计数板)有“白”的部分(4个大方格)用于本实验细胞的计数。
快速计数方法:
在“白”字部分的1大方格中(实际上有16个中方格)
若有1个细胞,细胞浓度为1x104个/ml.
若有10个细胞,细胞浓度为1x105个/ml.
快速计数有“白”的部分4个大方格的细胞数总数N.
则细胞浓度为:N/4 x104个/ml
本实验的植物细胞培养最适浓度为5x105个/ml。
|
五、实验要求
同上
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:超净工作台,恒温水浴锅,普通离心机,培养室,倒置显微镜,体视显微镜,离心管,三角烧瓶,烧杯,400目尼龙网,滴管,血球记数板,培养皿,移液管 parafilm,MS培养液所需的各种药品和试剂等。
《细胞工程实验》课程实验项目4
骨髓瘤细胞的培养和制备
一、实验目的
学习与掌握骨髓瘤细胞的培养方法,制备足够数量的骨髓瘤细胞,用于融合制备杂交瘤细胞。
二、实验内容
1.骨髓瘤细胞半贴壁培养
2.制备杂交用的骨髓瘤细胞
三、实验原理
用于制备杂交瘤的骨髓瘤细胞(myeloma)一般具备以下特点:能在体外长期传代,呈无限制性增殖;自身不分泌或极少分泌免疫球蛋白;有特殊的遗传学标记,属于营养缺陷型,(HGPRT和TK缺陷型)在HAT选择培养液中不能生长,当它与免疫的正常脾细胞融合后,由于重新获得了缺失的代谢酶,能够在HAT筛选培养基中存活而被选择出。用于制备单克隆抗体杂交瘤的骨髓瘤细胞系有很多种类,小鼠的SP2/0-Ag14是常用的骨髓瘤细胞系。
四、实验方法与步骤
1、在制备杂交瘤前7~10天,将在液氮中冻存的小鼠骨髓瘤细胞取出复苏,并培养3代以上。
2、选择生长旺盛,形态良好的细胞作为种子细胞进行扩大培养,一般在融合前48小时进行。倾去培养液,加3-5m10.02%EDTA漂洗一下,倾去EDTA放置1一2分钟,加RPMI1640培养液,轻轻吹打细胞,计数,调整细胞浓度至5×104~105/毫升,接种于100毫升培养瓶,约2~3瓶,每瓶加10毫升,同上条件下培养。
3、在融合实验当天取处于对数生长期的小鼠骨髓瘤细胞EDTA消化离心收集,并用无血清培养液洗2次,悬浮于10毫升RPMI1640培养液中。
4、取细胞悬液用台盼蓝排除试验进行活细胞计数,一般要求活细胞数量应在90%以上。计数后,取3×107个细胞,并放入一个离心管中备用。
五、实验要求
同上
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:烧杯,镊子,各型号的三角烧瓶,封口膜,棉线,酒精灯,酒精棉花,火柴,标签纸或记号笔,滴管,滤纸,试剂瓶,电炉或微波炉,天平称,称量纸,高压灭菌锅,过滤灭菌器超净工作台,培养箱或培养室。75%乙醇,无菌水,超低温冻存的小鼠骨髓瘤细胞系SP2/0-Ag14、细胞培养瓶、离心管(灭菌)、血球计数板、C02培养箱、离心机、RPMI1640培养液(加双抗)、小牛血清、0.5%台盼蓝等
《细胞工程实验》课程实验项目5
免疫脾细胞的制备
一、实验目的
学习从脾脏组织制备免疫细胞的方法,从免疫脾脏中制备免疫细胞悬液,用于杂交瘤细胞的融合。
二、实验内容
从免疫的小鼠中制备免疫脾细胞
三、实验原理
小鼠经抗原多次免疫后,可从脾脏组织细胞分裂和分化出较多能分泌相应抗体的B淋巴细胞,脾脏内细胞连接不紧密可通过机械分离和过滤网筛选,将这些细胞制备成游离的单个细胞悬液。脾脏内常含有大量的血细胞,利用细胞的不同沉降系数,可用淋巴细胞分离液分离淋巴细胞,也可利用红细胞的特异透性将红细胞破碎获得较纯的淋巴细胞,从脾脏中分离的细胞与骨髓瘤细胞融合后即成为杂交瘤细胞。
四、实验方法与步骤
1、取1~2只同批免疫的BALC/C小鼠,经眼眶采血后分离血清,检测抗体。
2、将小鼠颈椎脱节处死后,浸泡于75%酒精中5分钟,固定解剖台板,小心剪开腹部皮肤,向两侧撕开,暴露腹壁,用无菌镊剪开腹膜左侧,无菌取出脾脏,放入盛有无血清培养液的平皿中,去除结缔组织,用PBS洗去血液。
3、在200目尼龙或不锈钢筛网上将脾切碎,用注射器芯轻轻挤压,使细胞分散,用无血清培养液冲洗,收集经过滤网的细胞,加培养液至10毫升。或用注射器在脾脏一端刺几个孔,另一端用注射器注入无血清培养液可将细胞从脾脏吹出,反复几次,并用镊子轻压脾脏,可将脾脏细胞基本吹出,一个小鼠脾脏约可收集2×108个细胞。
4、将细胞1000转离心5分钟,台盼兰检活,收集沉淀细胞置淋巴细胞分离液上,离心,取上层淋巴细胞,也可加经红细胞裂解液5ml,静止5分钟,离心收集脾淋巴细胞,用无血清培养液洗一次,再悬浮在10毫升无血清培养液中。
5、进行细胞计数,取1×108脾淋巴细胞悬液备用。
五、实验要求
同上
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:烧杯,镊子,酒精灯,酒精棉花,火柴,标签纸或记号笔,滴管,滤纸,试剂瓶,电炉或微波炉,天平称,称量纸,高压灭菌锅,过滤灭菌器超净工作台,培养箱或培养室。无菌水,超低温冻存的小鼠骨髓瘤细胞系SP2/0-Ag14、细胞培养瓶、离心管(灭菌)、血球计数板、C02培养箱、离心机、RPMI1640培养液(加双抗)、小牛血清、0.5%台盼蓝,抗原免疫后的BALB/C小鼠、培养皿、手术剪、镊子、75%乙醇、滴管、血球计数板、台式离心机、超净工作台、RPMI1640 培养液、PBS等。
《细胞工程实验》课程实验项目6
骨髓瘤与脾细胞杂交实验
一、实验目的
学习和掌握动物细胞融合的基本方法 ,通过免疫脾细胞与骨髓瘤细胞融合,制备杂交瘤细胞,并进行选择。
二、实验内容
细胞融合和培养选择
三、实验原理
将小鼠免疫脾细胞与骨髓瘤细胞融合制备杂交瘤,是单克隆抗体研制的重要关键步骤。由于分泌抗体的B淋巴细胞一般不能在体外培养条件下长期存活,肿瘤细胞虽然能在体外培养条件下长期存活,但又没有分泌抗体的能力,所以如将两者细胞融合,形成杂交瘤细胞,则这种细胞就具有既能在体外长期生长的特性,又有分泌抗体的能力。
融合细胞可以通过化学、物理或生物学的方法获得,生物学方法常以病毒如粘液病毒群中的仙台病毒为媒介,促进细胞融合;物理学方法常用电脉冲使细胞融合,化学方法则常用聚乙二醇(PEG)来促进细胞融合,细胞融合的机制尚不完全清楚,一般认为可能是在克服细胞之间的静电排斥,细胞紧密相靠时使细胞膜的脂类分子发生重排,从而使细胞膜互为打开而发生融合。
免疫脾细胞与骨髓瘤细胞融合实验后,能产生五种细胞类型,即未融合的脾细胞和骨髓瘤细胞,自身融合的脾细胞和骨髓瘤细胞以及脾细胞和骨髓瘤细胞融合而成的杂交瘤细胞, 其中杂交瘤细胞是我们所需要的,因此就要将杂交瘤细胞从上述细胞中选择出来。一般使用HAT选择培养基进行选择,HAT培 养基中含有次黄嘌呤 (Hypoxanthine)、氨基喋岭(Aminopterin)和胸腺嘧啶核苷(Thymidine)。细胞的DNA合成有内源性途径(主要途径)和外源性途径(旁路途径)两种方式。内源性途径就是利用谷氨酰胺或单磷酸尿苷酸在二氢叶酸还原酶的催化下合成DNA,而外源性途径则是利用次黄嘌呤或胸腺嘧啶、在次黄口嘌呤鸟嘌呤磷酸核糖转移酶(hypoxanthine guanine phosphoribosyltransferase,HGPRT)或胸腺嘧啶激酶(thymidine kinase,TK)的催化下来补救合成DNA,HAT培养基中的氨基喋岭是二氢叶酸还原酶的抑制剂, 能有效地阻断 DNA合成的内源性途径。B淋巴细胞具有HGPRT和TK这两种酶,因此在内源性途径被阻断后仍能利用HAT培养基中的次黄嘌呤和胸腺嘧啶来合成DNA,可在HAT培养基中存活,但由于淋巴细胞在体外的生长有限,故不能长期存活。杂交瘤技术中所使用的骨髓瘤细胞为HGPRT-和TK-的缺陷型,缺乏HGPRT酶和TK酶,在内源性途径被阻断后不能进行DNA的外源性合成,故不能在HAT培养基中存活。杂交瘤细胞由于继承了B淋巴细胞和骨髓瘤细胞的双重特性,能够合成HGPRT酶和 HK酶,故在HE培养基中能长期存活。因此将融合后的混合细胞在HAT培养基中培养两周后,只有杂交瘤细胞能存活下来,成为制造单克隆抗体细胞源。
四、实验方法与步骤
1 、将RPMI1640培养液和50%(W/V )PEG,分别放入37 ℃水浴中预温。将一只盛水的烧杯也放入水浴中预温备用。
2 、将2.5*107脾细胞与2.5*106—7.5*106骨髓瘤细胞在10毫升离心管中混匀,以1000转/分离心5分钟,将上清液尽量倒尽, 用手指尖轻弹管底,使两种细胞的沉淀物充分混匀成糊状。
3 、将离心管置于在37 ℃水浴中预温的盛水烧杯中,用1毫升吸管吸取己经预温到37℃的PEG溶液0.5毫升,将吸管管尖插入离心管底,轻轻搅动细胞沉淀物,并缓缓滴加PEG,在1分钟内加完。然后在水浴中静置90秒钟。
4 、继续滴加已经预热到37℃的无血清RPMI1640培养液10毫升,使PEG稀释而失去作用。加RPMI1640培养液的方法是: 前半分钟,加1毫升;后半分钟,加3毫升;然后在第2分钟内加完10毫升。
5 、经1000转/分离心l0分钟,弃上清液。
6 、将沉淀的细胞轻轻悬浮于10毫升含10%新生牛血清的1640培养液中,接种到一块有饲养细胞层的96 孔板中,每孔0.1毫升,置37℃5%C02培养箱中培养。
7、 24h后补加2 × HAT-2培养液lOOul
8 、自融合开始 ,每隔3~4天半量换一次HAT培养液,以补充营养和核酸合成旁路的原料(次黄嘌呤和胸腺嘧啶),至8~10天,用半量换液法以HT培养基逐步替代HAT,2周后可换HT培养液,3周后可换完全培养液。一般培养3~5天即可出现小克隆,杂交细胞体积较大,呈圆形且透明,其它细胞透光性差并逐渐死亡。培养8~12天,克隆可长至孔面积的1/3~1/2,此时可取培养上清液,进行抗体检测。一旦检测到分泌预定抗体的克隆,应及时将阳性克隆转种于24孔培养板,再进一步转入培养瓶扩大培养,冻存部分克隆细胞,同时进行克隆化培养。
五、实验要求
同上
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:制备好的骨髓瘤细胞和脾细胞悬液、已接种饲养细胞的96孔细胞培养板、50ml烧杯、离心管、水浴锅、台式离心机、 C02培养箱、超净工作台、 HAT 培养液、 RPMIl640 培养液、小牛血清、 50%(W/V )聚乙二醇 (PEG )等。
《细胞工程实验》课程实验项目7
动物细胞的原代培养
一、实验目的
了解和掌握动物细胞原代培养的基本方法,熟悉组织块法和消化法培养的基本操作过程
二、实验内容
动物细胞、组织及器官进行离体培养
三、实验原理
原代细胞培养是指直接从动物体内获取的细胞、组织或器官,经体外培养后直到第一次传代为止。原代培养首先用无菌操作的方法,从动物体内取出所需的组织或器宫,切成一定大小的组织块,直接或经消化分散成为单个游离的细胞,人工培养条件下,使其不断地生长、繁殖。细胞培养是一项操作繁琐而又要求十分严格的实验技术,要使细胞在体外长期生长,必须要供给细胞存活所必需的条件,如适量的氨基酸、无机盐、水、维生素、碳水化合物,相关的各种生长因子、氧气、适宜的温度、酸碱度和渗透压等,同时必须要严格控制无菌条件。
四、实验方法与步骤
(一)组织块法培养的基本操作
1、操作者进入无菌室前先用肥皂洗净双手,然后用1‰新洁尔灭浸泡消毒5分钟(需临时带进无菌室内的工具也一并用1‰新洁尔灭浸泡消毒)。
2、将小白鼠颈动脉放血处死(在动物细胞培养中,为避免过多血细胞的干扰,一般采用颈动脉放血的方法处死动物),然后用75%酒精或1‰新洁尔灭浸泡消毒,迅速进入无菌室。
3、将小白鼠置超净工作台上,使其背部朝上,先用碘酒棉球消毒背部的被毛,再用75% 酒精棉球擦试碘酒擦过的部位。
4、在腰部的后缘,用解剖镊提起皮肤,用解剖剪剪开皮肤,将剪开的皮肤分别拉向两侧,再换用一把解剖剪和解剖镊,剪开背部的肌肉,暴露出腹腔,取出肾脏,置无菌培养皿中。
5、用眼科剪和镊,将肾外膜剪破,并将其剥向肾门,去肾外膜及脂肪,用Hank's液洗涤一次,将洗涤过的肾脏转入另一培养皿中,另换一把眼科剪和镊,沿肾脏的纵轴剪开,去掉肾孟部分,用Hank's液将肾脏连续漂洗3~5次,每漂洗一次更换新的Hank's液,漂洗后置表面皿中,加入少量1640培养液,用锋利的解剖刀将组织块切成大小约1~2立方毫米的小块。
6、用弯头镊子将组织小块移入细胞培养瓶中(在培养瓶上预先注明细胞类型、组别、操作者姓名、日期等),将它们粘附在培养瓶的瓶壁上,并整齐地排列成行,每块组织间相距约2~3mm, 随即翻转细胞培养瓶,使贴组织块的一面朝上,轻轻加入培养液4ml〈注意此时培养液不要接触到组织块〉。
7、将贴有组织块的细胞培养瓶小心移入37℃C02恒温培养箱中(注意贴有组织块的一面朝上),静止2~3小时,然后将细胞培养瓶轻轻翻转,使组织块浸入培养液中,继续静止培养8、24~48小时后若培养液变成黄色且混浊,表示已被污染;若培养液变成紫色,一般细胞生长不好,则培养液pH过高;若培养液显为橙黄、橘红且清澈,一般显示细胞生长良好。在相差显微镜下观察,若此时见细胞自组织边缘长出(出现生长晕),则继续培养3~5日,再换部分或全部培养液,待多数组织块的生长晕相接,小心挑掉组织块,继续培养3~4天,细胞贴满细胞培养瓶壁时便可进行传代培养。
(二)消化法培养的基本操作
1、操作者先用肥皂洗净双手,然后用1‰新洁尔灭浸泡消毒5分钟(需临时带进无菌室内的工具也一并用1‰新洁尔灭浸泡消毒)。
2、将小白鼠颈动脉放血处死,然后用75%酒精或1‰新洁尔灭浸泡消毒,迅速进入无菌室。
3、将小白鼠置超净工作台上,使其背部朝上,先用碘酒棉球消毒背部的被毛,再用75%酒精棉球擦试碘酒擦过的部位。
4、在腰部的后缘,用解剖镊提起皮肤,用解剖剪剪开皮肤,将剪开的皮肤分别拉向两侧,再换用一把解剖剪和解剖镊,剪开背部的肌肉,暴露出腹腔,取出肾脏,置无菌培养皿中。
5、用眼科剪和镊,将肾外膜剪破,并将其剥向肾门,去肾膜及脂肪,用Hank's液洗涤一次,将洗涤过的肾脏转入另一培养皿中,另换一把眼科剪和镊,沿肾脏的纵轴剪开,去掉肾孟部分,用Hank's液将肾脏连续漂洗3~5次,每漂洗一次更换新的Hank's液,漂洗后置表面皿中,用锋利的解剖刀或眼科剪将组织块剪切成大小约1~2立方毫米的小块。
6、将组织小块转入无菌试管中,再用Hank's液洗涤2~3次,直到液体澄清。然后将洗涤过的Hank's液吸掉,按组织块体积的5~6倍量,加入25% 胰蛋白酶消化液(pH7.6~7.8),置37℃水浴中进行消化,消化时间在20~40分钟左右(消化时间与胰蛋白酶活性及浓度、不同动物及年龄、组织块的大小等因素有关),每隔5分钟,摇动一次试管,以便组织块散开,有利于继续消化,直到组织变成松散、粘稠状,并且颜色略变成白色为止。
7、将试管从水浴中取出,吸去胰蛋白酶液,加入适量Hank's液,用吸管轻轻吹打组织块,直到大部分组织块分散成均匀的细胞悬液,然后用孔径为100~200目的不锈钢筛网过滤,以除去部分较大的组织碎片,所得滤液经100Orpm离心5分钟,收集细胞,并将所得细胞再用Hank's液离心洗涤2~3次(每次lOOOrprn离心5分钟),加入适量1640培养液。
8、吸取lml细胞液,用血球计数板计数,若细胞悬液中细胞密度过大,则补加培养液。若细胞密度过稀,则离心后减少加入的培养液。一般细胞密度以3.O~5.O×105/ml为宜。
9、将调整好密度的细胞悬液分装子细胞培养瓶中(一般3~5ml/25ml细胞培养瓶),盖好瓶塞,在培养瓶上注明细胞类型、组别、操作者姓名、日期等,然后将细胞置37℃C02 恒温培养箱中培养。
10、同组织块法一样逐日对培养的细胞进行观察,若培养液变成紫色,一般细胞生长不好,则培养液pH过高;若培养液显为橙黄、橘红且清澈,一般显示细胞生长良好。若此时见大部分细胞贴壁生长,则可更换部分或全部培养液,继续培养3~5日,待细胞长成单层,便可进行传代培养。
五、实验要求
同上
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:烧杯,镊子,酒精灯,酒精棉花,火柴,标签纸或记号笔,滴管,滤纸,试剂瓶,电炉或微波炉,天平称,称量纸,高压灭菌锅,过滤灭菌器超净工作台,培养箱或培养室。无菌水,超低温冻存的小鼠骨髓瘤细胞系SP2/0-Ag14、细胞培养瓶、离心管(灭菌)、血球计数板、C02培养箱、离心机、RPMI1640培养液(加双抗)、小牛血清、0.5%台盼蓝,抗原免疫后的BALB/C小鼠、培养皿、手术剪、镊子、75%乙醇、滴管、血球计数板、台式离心机、超净工作台、RPMI1640 培养液、Hank's平衡盐液,0.25%胰蛋白酶消化液,出生后2~3天的乳鼠,PBS等。
《细胞工程实验》课程实验项目8
细胞冻存和复苏
一、实验目的
学习与了解细胞超低温冻存与复苏的基本原理,初步掌握培养细胞常规超低温冻存与复苏以及玻璃化超低温冻存与复苏的方法
二、实验内容
细胞的低温保存及复苏
三、实验原理
为了保持细胞株(系)遗传的稳定性以及非连续使用细胞的长期保存,人们建立了细胞超低温冻存与复苏技术。目前细胞超低温冻存技术主要有两种方法,即常规超低温冻存和玻璃化超低温冻存。
活细胞在超低温下克服了分子间的热运动,因而可长期保存而不影响活力。然而在冷冻时,细胞内外水分会很快形成冰晶,冰晶的形成会引起一系列不良反应,如细胞脱水,局部电解质浓度增高,pH值改变,蛋白质、酶变性,膜结构损伤,DNA破坏等,最后导致细胞死亡。因此在冻存时,减少细胞内冰晶的形成是减少细胞损伤的关键。目前多采用冷冻保护剂减少冰晶的形成,常用的冷冻保护剂有二甲基亚枫(DMSO)和甘油,这两种物质对细胞无明显毒性,分子量小,溶解度大,易穿透细胞,增大膜对水的通透性,并可以使冰点下降,在缓慢冷冻条件下,可使细胞内的水分渗出细胞外,在胞外形成冰晶,减少胞内冰晶的形成。常规超低温冻存一般以每分钟下降1~2℃的速率进行,当温度降至-25℃以下,可增至每分钟-5~-10℃的速率进行,到-80℃时,可直接投入液氮中(-196℃)。细胞复苏时一般要快速融化,以防止细胞内冰晶的再次形成,防止冰晶对细胞的损伤。
玻璃化超低温保存技术是将生物样品经玻璃化保护剂脱水后,直接投入液氮中,使细胞内外在快速降温时进入一种均一的无定型形态,细胞内的水不转变成冰,而是形成过冷液体,并最终固化成玻璃态。玻璃化冻存法具有快捷、细胞存活率高等优点而得到广泛应用。
四、实验方法与步骤
(一)常规超低温冻存与复苏
1、超低温冻存
(1)、从增殖期到形成致密的单层细胞以前的培养细胞都可以用于冻存,但最好为对数生长期的细胞,己长满的细胞冻存后生存率较低。在冻存前一天最好换一次培养液。
(2)、按传代培养的方法,用0.25%胰蛋白酶或0.02%EDTA消化液把单层生长的细胞消化下来(悬浮生长的细胞则不需这一步处理),将消化好的细胞收集于离心管中,100Orpm/min离心5分钟。
(3)、去除消化液,加入适量含10%DMSO(或甘油)的1640培养液,轻轻悬浮细胞,计数,并调整细胞密度至2~5×106个/ml,分装于细胞冻存管内,每管0.5~lml。
(4)、作好标签后,将冻存管装入己做标签的小袋或支架上,放入吊桶内。标准的冻存程序为降温速率-1~-2℃/min,当温度达-20℃以下时,可增至-5~-10℃/min,到-100℃时,可迅速浸入液氮中。(注意:各种细胞对冷冻的耐受性不同,一般来说,上皮细胞和成纤维细胞耐受性大,骨髓细胞差一些,胚胎细胞耐受性最小。总之,在开始时温度下降速度不能超过-10℃/min。要精确控制冷冻速度需要特定的程序降温仪,如无此设备,一般可以采用以下几种方法来控制冷冻速度:(a)将细胞冻存管置于装有异丙醇的塑料盒内,放入-80℃冰箱中,经过3小时以后,移入液氮吊桶内,放入液氮中。记录冻存管位置和编号,在放入液氮操作时要带手套,以免冻伤;(b)将冻存管装入己做标签的小袋或支架上,放入吊桶内,从液氮容器口缓缓放入,按1~2℃/min的降温速度,在30~40分钟内,使其到达液氮表面,再停留30分钟,直接投入液氮中。
2、复苏
(1)、复苏细胞与冻存的要求相反,应采用快速融化的手段,这样可以保证细胞外的冰结晶在很短的时间内即融化,避免由于缓慢融化使水分再度形成胞内冰晶,对细胞造成损害。
(2)、戴手套,缓缓从液氮罐内提升冻存架,按编号用镊子迅速从液氮中取出冻存管,直接投入37~40℃的水浴中,并不时摇动,使其快速(1分钟之内)融化。
(3)、用新洁尔灭消毒冻存管,在无菌室超净工作台上,打开冻存管用吸管吸出细胞悬液,注入离心管,加入10倍以上量的培养液,混合后低速离心,除去上清液,再重复用培养液洗一次。
(4)、经洗涤后的细胞用培养液适当稀释,接种于细胞瓶,置37℃培养箱静止培养,次日更换一次培养液,继续培养。如果复苏时细胞密度较高,要及时传代。
(二)玻璃化超低温冻存与复苏
1、玻璃化超低温冻存
(1)、将传代培养的单层细胞,用O.25%胰蛋白酶或0.02%EDTA消化液消化后加
适量培养液中止消化作用,收集细胞子离心管中,1000rpm/min离心,5分钟。
(2)、用1640培养液,轻轻悬浮细胞,计数,调整细胞密度至2~5×106个/ml。取0.5ml细胞悬液,加入O.5m110%浓度的玻璃化冷冻保护剂(PVS2)(配制方法见附录),4℃过渡5分钟,然后4℃250Orpm离心5分钟,弃上清,加入0.5m1100%PVS2保护剂,作好标签后,4℃放置5分钟,直接投入液氮冻存。
2、复苏
(1)、从液氮中取出冻存管,直接投入37~40℃的水浴中,并不时摇动,使其快速(1分钟之内)融化。
(2)、在无菌室超净工作台上,用吸管吸出细胞悬液,注入离心管,加入10倍以上量的培养液,混合后低速离心,除去上清液,再重复用培养液洗一次。
(3)、经洗涤后的细胞用培养液适当稀释,接种细胞瓶,置37℃培养箱静止培养,次日更换一次培养液,继续培养。如果复苏时细胞密度较高,要及时传代。
五、实验要求
同上
六、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:烧杯,镊子,酒精灯,酒精棉花,火柴,标签纸或记号笔,滴管,滤纸,试剂瓶,电炉或微波炉,天平称,称量纸,高压灭菌锅,液氮罐,低温冰箱,过滤灭菌器,超净工作台,细胞培养瓶、离心管(灭菌)、血球计数板、C02培养箱、离心机、RPMI1640培养液(加双抗)、小牛血清、0.5%台盼蓝,培养皿、手术剪、75%乙醇、滴管、血球计数板、台式离心机、超净工作台、RPMI1640 培养液、Hank's平衡盐液,0.25%胰蛋白酶或0.02%EDTA消化液,DMSO,15%乙二醇、0.04M蔗糖或海藻糖,液氮,小鼠SP2/O,PBS等。
《细胞工程实验》课程实验项目9
细胞活性测定
一、实验目的
了解并掌握染料排斥法、 FDA-PI 双色荧光检测法和 MTT 检测法等测定培养细胞活性的方法,并能具体运用到实践中。
二、实验内容
细胞培养过程中细胞的活性测定
三、实验原理
细胞活性测定是一项基本而重要的技术。细胞活性测定的方法较多,如染料排斥法、 FDA-PI双色荧光检测法和MTT 检测法等都是常用的方法。染料排斥法是利用细胞损伤或死亡时,某些染料如台盼蓝、伊红 Y 、苯胺黑等可穿透变性的细胞膜,与解体的 DNA 等结合,使其着色,而活细胞的选择透性能阻止这类染料进入细胞。
FDA-PI双色荧光检测法是利用 FDA (Fluorescein Diacetate, 双醋酸荧光素)能被活体细胞所吸收,掺入活细胞后,在细胞内醋酸酯酶等作用下,释放出荧光素,在蓝色光激发下发射出黄绿色的荧光来,细胞活性越高,则酶活性越高,黄绿色荧光越强;PI(Propidium Iodide, 腆化丙啶 )只能进入有缺损的膜或固定的死亡细胞,在蓝色光激发下发射出桔红色的荧光。
MTT 法是利用细胞线粒体呼吸链上的琥珀酸脱氢酶对噻唑蓝 (tetrazoliium 简称 MTT)还原成难溶的蓝紫色结晶一甲濳(Fomuan ),经二甲基亚砜(DMSO )溶解后在波长 49Onm 处测定其光吸收值,其值可间接反映细胞的活性状态以及活性细胞的数量。
四、实验方法与步骤
(一)染料排斥法
1 、台盼蓝排斥试验
将培养细胞制成单细胞悬液,并作适当稀释 (106细胞 /ml),取 9 滴细胞悬液移入小试管中,加一滴 0.4% 台盼蓝染液混匀,在 3 分钟内用血球计数板计数活细胞和死细胞数,计算细胞存活率。其中活细胞拒染色,而死细胞被染成淡蓝色,细胞存活率 (% ) = 活细胞总数 / 活细胞总数十死细胞总数。
2 、伊红 Y 排斥试验
将培养细胞制成单细胞悬液,并作适当稀释 (106细胞 /ml), 取 0.lml 细胞悬液,加 O .1ml细胞悬液,加0.02% 伊红 Y 染液混匀,用血球计数板计数活细胞和死细胞数,计算细胞存活率。其中活细胞拒染色,而死细胞被染成红色,细胞存活率 (%) = 活细胞总数 / 活细胞总数十死细胞总数。
3 、苯胺黑排斥试验
将培养细胞制成单细胞悬液,并作适当稀释 (106细胞 /ml ),取 O.1ml细胞悬液, 加 0.lml 0.1% 苯胺黑染液混匀,室温放置 10 分钟,用血球计数板计数活细胞和死细胞数,计算细胞存活率。其中活细胞拒染色,而死细胞被染成黑色,细胞存活率 (%) = 活细胞总数 / 活细胞总数十死细胞总数。
(二)荧光测定法
1、 FDA-PI 双色荧光镜检法
将培养细胞制成单细胞悬液,并作适当稀释 (106细胞 /ml), 取 5Oul 细胞悬液滴到载玻片上,加入 FDA-PI 染液50ul, 轻轻混匀静止 1~2 分钟后,盖上盖玻片,将细胞置于荧光显微镜下观察。观察时用落射荧光照射,光源为高压汞灯,激发波长为 45Onm, 阻挡滤片为53Onm 。观察结果为:活性高的细胞发出强烈的黄绿色荧光,活性低的稍显黄绿色,死亡细胞呈桔红色。
2 、 FDA-PI 双色荧光分光光度测定法
将培养细胞制成单细胞悬液,并作适当稀释 (106 细胞 /ml),取 2ml 细胞悬液以及 FDA-PI染液1ml,加入试管中,轻轻混匀静止 1~2 分钟后,加入比色皿中,用荧光分光光度计测定荧光强度,记录图谱,激发波长为 45Onm。从记录图谱可以观察到,染色后的细胞悬液发射出波长分别为 518nm和 598nm的两种荧光,前者为 FDA 发出的黄绿色荧光,其强度代表活细胞的数量和活性,后者为 PI 发出的桔红色荧光,其强度代表死细胞的数量,从 FDA/ PI的比值,可以直观反映出细胞活性的变化。
(三) MTT 测定法
1、 MTT 测定法的操作:
(1)将培养细胞制成细胞悬液,用培养液调整浓度至2*105 个/ml,用微量加样器将细胞悬液接种于96孔板中,每孔100ul。
(2)每孔加入MTT反应液50ul, 轻轻摇匀,置37 ℃ 5%C02培养箱中培养2~4小时,200Orpm离心10分钟,弃上清。
(3)加入PBS, 离心洗涤一次,再加入 DMSO, 每孔200ul, 室温放置10分钟,并不时摇动,以溶解细胞。
(4)以无细胞空白孔为调零孔,选择49Onm波长,在酶联免疫检测仪上测定MTT反应孔的光吸收值 (OD490)。
2 、用MTT法测定CdC12 对细胞活性的影响
(l) 在接种好细胞的96孔培养板内,分别加入系列浓度的CdC12溶液, 每孔100μl, 处理0.5小时。
(2)弃除 CdC12溶液,用PBS离心洗涤2次。
(3)用MTT法测定各组细胞活性,比较各种不同浓度的CdCl2处理前后细胞活性的变化。
五、实验要求
同上
七、场地、设备与器材
场地:10幢-404-406,407-409细胞工程实验分室
设备与器材:酶联免疫检测仪、离心机、荧光分光光度计、微量加样器、96孔板、普通显微镜、荧光显微镜和血球计数板、1640 培养液、2mg/mlMTT( 用 PBS 配制)、消化液、 DMSO以及系列浓度的CdC12溶液 (用PBS配制)、台盼蓝染液、伊红 Y 染液、苯胺黑染液、 FDA-PI 荧光染料等。